3月30日,中国科学院上海药物研究所在嘌呤能受体P2Y1R结构生物学领域取得突破性进展,首次测定了该受体蛋白的高分辨率三维结构,揭示了P2Y1R抑制剂分子的作用机理,为研究治疗血栓性疾病的新型药物提供了重要的依据,未来将开启G蛋白偶联受体(GPCR)药物研发的新方向。研究成果于北京时间3月30日晚11点在国际学术期刊Nature 以长文(Article)的形式在线发表,研究论文的通讯作者为上海药物所研究员吴蓓丽和赵强,第一作者为博士研究生张丹丹。
血栓性疾病包括中风、冠心病、肺栓塞等各种疾病,是严重威胁人类生命健康的重要疾病之一。目前,我国血栓性疾病患者超过1千万,发病率远高于其它疾病,且有逐年递增的趋势。在血栓性疾病的发病过程中,位于人体内血小板表面的两种重要的GPCR——嘌呤能受体P2Y1R和P2Y12R是刺激血小板凝集、导致血栓形成的关键因子,抑制这两种受体蛋白的活性能够有效地缓解血栓的生成,因此P2Y1R和P2Y12R是极其重要的抗血栓药物靶标,其抑制剂的研发是当今医药学研究的热点之一。
目前,上市的抗血栓药物主要以P2Y12R为靶标,年销售额可达数十亿美元,但是这些靶向P2Y12R的药物均存在一定的副作用,例如出血时间较长、可导致病人呼吸困难等。靶向P2Y1R的药物研发目前仍处于研发阶段,尚无药物成功上市,然而大量研究表明,P2Y1R抑制剂较P2Y12R药物可显著缩短出血时间,因此,P2Y1R是目前极具潜力的新型药物靶点。一直以来,由于 P2Y1R结构信息的缺失,限制了人们对于这种受体与抑制剂分子作用机制的理解,因而制约了P2Y1R药物的研发。
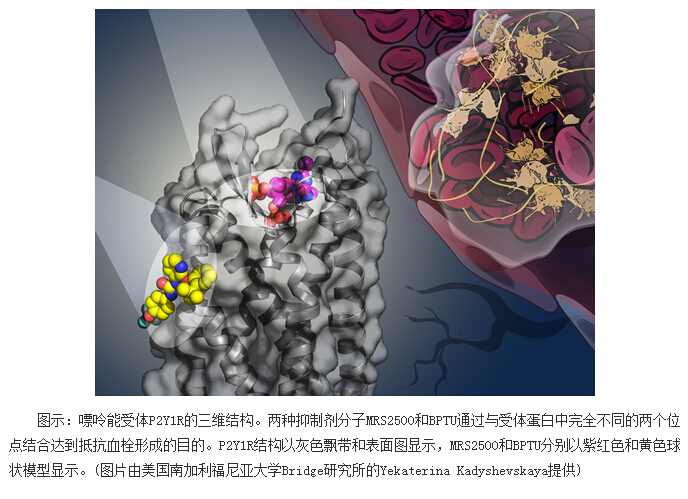
2014年,上海药物所的科研团队成功解析了P2Y12R受体的三维结构,首次揭示了嘌呤能受体与药物分子的结合方式。2015年,该研究团队进一步解析了P2Y1R分别与核苷酸类抑制剂MRS2500和非核苷酸类抑制剂BPTU结合的复合物三维结构。“P2Y1R结构有助于深入理解这种受体蛋白与不同药物先导分子的相互作用机制,可以帮助人们设计出副作用较小、更为安全的新型抗血栓药物,”该研究的负责人——上海药物所研究员吴蓓丽说。
通过分析P2Y1R结构,研究人员获得了许多重要的发现,其中最令人兴奋的是P2Y1R同时具有完全不同的两个药物分子作用位点,并且两种抑制剂与受体的作用机制显著区别于人们过去对于GPCR的传统认知。虽然,P2Y1R的核苷酸类抑制剂MRS2500的结合位点位于受体蛋白的跨膜螺旋内部,但是,这一位点与P2Y12R受体中核苷酸类药物的结合位点在形状和位置上均存在巨大差异。尽管在人体内,P2Y1R和P2Y12R的天然配体是同一种核苷酸分子——二磷酸腺苷(ADP),但是这两种受体蛋白与核苷酸分子的结合模式完全不同。吴蓓丽说:“两种GPCR受体识别同一类配体的方式具有如此大的差异,这着实令人吃惊。这些发现充分体现了GPCR对细胞信号识别机制的多样性,对于我们针对每一种受体蛋白设计高特异性的药物分子具有极高的指导意义。”
更加令人吃惊的是,不同于其它所有已知的GPCR结构,P2Y1R的非核苷酸抑制剂BPTU作用于受体蛋白的外表面,深埋于细胞膜的脂分子中。这是首次发现与GPCR受体外表面结合的高选择性配体,极大地拓展了未来开展GPCR药物研发的方向。“在传统的GPCR配体结合位点以外区域寻找全新的药物分子识别位点有可能极大提高药物的特异性并降低其副作用,过去人们对此从未关注过,P2Y1R三维结构开启了GPCR功能研究和药物研发的新方向,”该项研究的另外一位负责人——上海药物所研究员赵强说。
“这些新结构能够帮助药物研究人员更加准确、高效地设计出新的药物,调控P2Y1R和其它类似受体蛋白的功能,”该研究的一位合作者——美国国立卫生研究院糖尿病、消化系统疾病和肾病研究所生物有机化学实验室首席科学家Kenneth A.Jacobson对此展望道:“这项研究还可能应用于肿瘤和炎症治疗。”
除了吴蓓丽、赵强、Kenneth A.Jacobson以外,该项研究的参与者还包括吴蓓丽研究组和赵强研究组的张丹丹、张凯华等多名研究人员,上海药物所研究员蒋华良、柳红及其研究组成员,美国国立卫生研究院的Zhan-Guo Gao、Evgeny Kiselev、Steven Crane、Silvia Paoletta,美国南加利福尼亚大学Bridge研究所教授Gye Won Han、Vadim Cherezov、Vsevolod Katritch 和Raymond C. Stevens(Stevens同时任职于上海科技大学iHuman研究所)。
该项研究(Two disparate ligand-binding sites in the human P2Y1 receptor)获得了来自科技部“973”计划(2012CB518000、2014CB910400、2012CB910400)、中科院战略先导科技专项(XDB08020300)、国家自然科学基金委(31422017、31370729、91313000)、国家科技重大专项(2013ZX09507001)、美国国立卫生研究院(Z01 DK031116-26、U54 GM094618)的资助。



