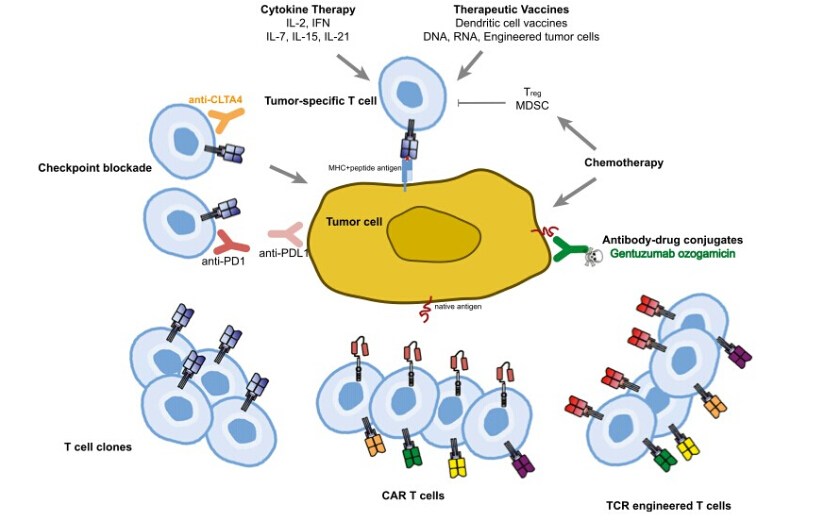
嵌合抗原受体(CAR)和T细胞受体(TCR)修饰的T细胞是当前过继性细胞治疗ACT技术中两大最新的技术,实现了从基础免疫学机制研究到临床免疫治疗应用的转变。因其能够表达人工合成受体并能特异性识别靶细胞,CAR-T和TCR-T正成为振奋人心的癌症治疗方法;对于慢性感染及自身免疫性疾病,它同样具有广泛的应用前景。合成生物学原理,以及免疫学和基因工程的进步,使得制备特异性功能增强型的人T细胞成为可能。在CD19特异性CAR-T细胞应用于B细胞白血病及淋巴瘤的临床试验中,成人和儿童患者均显示出持续性缓解效果。近期制药工业界的加入,使得工程化T细胞的应用前景发生了巨大的变化。在此综述中,爱康得生物编译作者PaulHsu将和大家一起分享国外临床科研工作者对肿瘤过继免疫治疗中已面临的挑战和未来机遇的探讨。
目前有三种使用效应T细胞的过继细胞疗法正朝着注册审批的方向行进(图1)。肿瘤浸润性淋巴细胞(TILs)虽发展缓慢,但数十年来一直进步,近期一项针对转移性黑色素瘤的国际III期随机试验已经开始。新近组建的LionBiotechnologies公司正商业化应用TILs治疗黑色素瘤和其他有T细胞浸润的肿瘤。
与TILs相比,开发转基因的方法克服对肿瘤特异性T细胞免疫耐受。这种方法通过转导嵌合抗原受体(融合抗原结合域及T细胞信号结构域)或者TCRα/β异二聚体,使T细胞能够重新高效的识别靶细胞。通过输注能够识别特异靶标的基因修饰T细胞,赋予免疫系统以新的非自然免疫活性。这种方法除了能像细胞毒性化疗和靶向治疗快速杀灭肿瘤外,还避免了疫苗和T细胞检查点疗法的延迟效应。
除了极个别情况外,细胞疗法的个性化指的是自体的、源于患者的T细胞。正因如此,过继细胞治疗的开发主要依赖于学术界与制药行业的紧密合作。在这个模式中,学术界与工业界共存,前者开发和检验细胞工程技术的新思路,后者扩大和实现新方法在医疗健康领域中的影响力。这种学界和工业界的合作伙伴关系已经在全球的许多机构中出现,包括宾夕法尼亚大学与诺华,贝勒医学院与BluebirdBio、Celgene公司,纪念斯隆-凯特林癌症中心、哈钦森弗莱德癌症研究中心与JunoTherapeutics公司,国立癌症研究所与Kite Pharma,西比曼与中国解放军总医院。总体来说,现在有数十家细胞治疗领域的企业总投资达数十亿美元。
这种合作关系的影响力仍不明确,学术界的学术自由与大型企业专注于价值相遇必将产生冲突,寻求校外的项目资金支持和知识产权的归属问题,将成为创造这个领域的学者与谋求获得技术授权的制药公司之间激烈争论的话题。
过继细胞治疗在HIV-1和其他慢性感染中的潜在角色
从历史角度来看,早在二十几年前,就已应用基因修饰T细胞对晚期艾滋病患者进行过继细胞治疗,早期来源于HIV患者的临床试验结果提供了目前应用于肿瘤过继细胞治疗的理念,例如CAR-T细胞可以在HIV-1/AIDS患者体内存活十余年。最初这些试验是为了控制HIV-1感染的耐药性,然而,目前该领域的挑战是开发细胞治疗的潜力,用来清除寄宿的耐受抗病毒治疗的HIV-1。GeroHutter等人进行的一项特别的试验使得该领域充满活力,感染HIV-1的患者,在接受同种异体造血干细胞(HIV阴性CCR5Delta32纯合子)移植的过继细胞治疗后被治愈。有许多方法诱导细胞产生对HIV-1感染的内在抗性,以及通过基因修饰的过继细胞输注疗法来靶向寄宿的HIV-1。最近研究表明,使用特异性CD8+CTLs进行过继细胞治疗可以清除人源化小鼠体内潜在的HIV-1病毒,为利用基因修饰的T细胞治疗HIV-1感染和其他内源性免疫系统不能控制的慢性感染提供了理论基础。随着构建具备人体免疫系统小鼠技术的不断提高,使用ACT治疗HIV-1感染的进程将得到非常大的推进。
改造调节性T细胞
利用调节性T细胞(Treg)抑制有害的免疫应答正引发越来越大的兴趣。这一方法的有效性已经在自身免疫性疾病和同种异体移植排斥反应的临床前模型中得到验证。在小鼠体内过继回输调节性T细胞能防止致命性移植物抗宿主病和自身免疫性糖尿病。经历同种异体造血干细胞移植的患者,接受扩增的脐带血Treg细胞已被证明是安全和可行的。研究人员开发了许多不同的细胞培养方法,以提高自然的和诱导的Treg细胞的扩增和功能。爱康得生物编译作者PaulHsu认为对不同细胞培养方案的需求差异,可能是由于Treg细胞和效应T细胞在信号转导方面的差异所致。合成生物学及生物工程原理已被用于Treg细胞,例如,CAR-Treg在自身免疫疾病的临床前研究模型中崭露头角,将CAR应用于Treg细胞的概念集中于通过CAR使Treg细胞聚集于易受攻击的组织,用来抑制那里的自身免疫。利用CAR修饰小鼠Treg细胞靶向髓鞘碱性蛋白特异性T细胞,可以防止自身免疫性脑炎。基于此理念,分别寻找结肠和胰岛的靶向抗原可防止结肠炎和糖尿病。
动物模型在ACT应用中的角色
动物模型在细胞治疗开发中起着关键的作用。目前研究者主要使用两种模型:一是同基因型小鼠模型,使用小鼠T细胞和小鼠抗原;二是异种移植瘤模型,使用免疫缺陷型小鼠和人源T细胞及人源肿瘤细胞。在细胞治疗发展的几十年里,使用这些模型经常会得出矛盾和相冲突的结论。细胞治疗中大量的可变因素是产生这些冲突的原因之一。CAR的结构、T细胞的类型构成(CD4/CD8,或2者兼有)、共刺激分子的选择、基因转导的方法、细胞体外扩增的时间和方法、宿主是否清髓、肿瘤类型和肿瘤负荷量等都必须准确掌控,才能获得准确的结论。比如,在异种移植瘤模型中已发现,体外扩增中不使用CD28刺激有益于使用CD28作为共刺激信号的CAR。
同基因型小鼠模型具有完整免疫系统的优点,而异种移植模型具有能够研究人类细胞的优点。一些嵌合抗原受体的研究使用异种移植模型准确预测其有效性。这些系统未能成功预测到任何毒性,特别是接受抗CD19CAR-T细胞治疗的小儿急性淋巴细胞白血病(ALL)产生的细胞因子释放综合征(CRS)(见下文)。尽管同基因型小鼠模型能预测疗效,但是尚未能模拟CRS,一部分是由于鼠源和人源T细胞在体外激活和扩增能力存在细微而重要的差别。作为临床试验显然专注于人源T细胞,研究人源T细胞共刺激信号的影响变得至关重要,且为使用异种移植瘤模型提供支持。更复杂的模型是使用人源化小鼠如MISTRG strain(转基因表达人细胞因子如的CSF, M-CSF,IL-3, 和促血小板生成素的免疫缺陷型小鼠)为人源细胞提供物种特异性细胞因子的支持,以便改善植入的这些细胞,并可能同时构造人源细胞有效性和毒性模型。其他混合型模型,如在SCID/beige小鼠中使用人T细胞与小鼠单核细胞系相互作用,可能会提供更深入的理解。但是,与人源化的小鼠模型相比,从真正奏效的同基因型小鼠模型得到的数据更不易让人迷惑。但目前异种移植模型所产生的数据的可操作性仍需提升。因此,同基因模型和人源化异种移植模型提供的信息可以互补,同源系统非常适合在完整的免疫细胞环境下研究鼠细胞生物学,而人源化系统可允许人体细胞的植入和人细胞与细胞之间在体内的相互作用。
开发最佳的CAR设计
过去的20年中CAR的设计已经取得了长足的进展(图2)。1991年有3个实验室报道了第一代CAR的设计。Kuwana等人最先构造了嵌合受体,使T细胞不依赖于MHC-I类分子识别靶细胞。Roberts、Finney和 Lawson 率先构造了含有CD28或4-1BB共刺激分子的二代CAR。在临床前模型中,使用基于CD28的体外扩增体系,在异种移植瘤模型中 4-1BB比CD28对CAR的功效更有益。两种CAR模型都显示出临床前和临床疗效。Long等人的最近研究表明,基于CD28构造的CAR加强并加速T细胞衰竭,而基于4-1BB构造的CAR减缓了T细胞衰竭。我们的研究结果与其结论一致,并且发现CD28内切域能传递使效应T细胞终末分化的信号。从这些研究中得出的周密的结论并不是说某个人源内切域必然比另一个好,而是说CD28信号是生产有效的临床T细胞制品的关键,而4-1BB提升了CAR-T细胞的持久性。



