众所周知,血小板在人体遭受损坏时起到了重要作用,是血液中有助于凝血的一种重要成分。干细胞可以分化成多功能细胞。脂肪干细胞是从脂肪组织中分离提取到的一种具有多功能的干细胞,主要能够促进细胞再生,恢复细胞修复功能。近日,有日本科研团队报告,利用脂肪干细胞,能够产生功能正常的血小板。
撰文丨Cel G
来源丨细胞快讯
血液学领域权威期刊《血液》(Blood)报道了一项来自日本庆应义塾大学医学院Yumiko Matsubara博士团队的实验室成果,结果显示,脂肪组织可以用来制造干细胞,并能在短短12天内产生功能正常的血小板。考虑到血小板的巨大临床需求,这一研究成果最终对减少对捐赠血小板的依赖,帮助癌症和其他疾病患者方面有巨大意义。
血小板在正常血液中有较恒定的数量,在止血、伤口愈合、炎症反应、血栓形成及器官移植排斥等生理和病理过程中都承担着重要作用。对于癌症、感染、免疫紊乱或血小板紊乱的患者,血小板有时可以挽救他们的生命。
依靠脂肪干细胞生产血小板
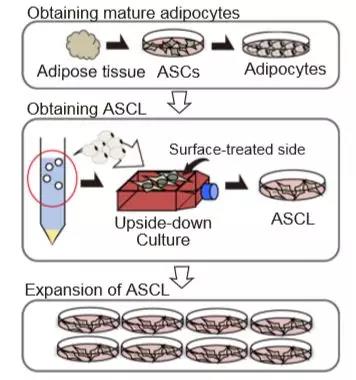
血小板是血液中有助于凝血的一种成分。全球每年有超过450万个血小板单位的血浆被输血。但由于捐献的血小板保质期不足一周,供应常常无法满足患者的需要。加上供体的感染和受体的免疫反应,捐献的血小板存在固有的安全风险。因此,Yumiko Matsubara博士带领的研究团队开发了一种血小板制造系统,该系统可来自于不依赖供者的细胞来源--人脂肪间充质干细胞系(adipose-derived mesenchymalstromal/stem cell line,ASCL)。
该研究采用倒置培养瓶法获得ASCL,且获得的ASCL满足国际细胞治疗学会所定义的间充质干细胞(MSCs)的最低标准。研究发现,ASCL表现出至少2个月的增殖能力,无任何异常核型。ASCL来源的巨核细胞(megakaryocyte,ASCL-MK)在培养第8天达到高峰。ASCL来源血小板(ASCL-PLT)在培养第12天达到峰值。
结果显示,与外周血小板相比,脂肪间充质干细胞生成的血小板(ASCL-PLT)具有更高水平的PAC1结合、p-选择素表面暴露、瑞斯托霉素诱导的血小板聚集、ADP诱导的血小板聚集;纤维蛋白原结合水平相似,胶原诱导血小板聚集。
此外,脂肪间充质干细胞生成的血小板(ASCL-PLT)具有较低的肾上腺素诱导血小板聚集。辐照免疫缺陷NSG小鼠体内注射后的体内动力学模式与浓缩血小板相似。ASCL-PLT在其他血小板群体中具有特征性,可能具有MSCs(间充质干细胞)的额外功能。并且ASCL的建立和向ASCL-plt的分化都不需要基因转移,只需利用内源性血栓生成素进行分化,且不需要饲养层细胞。因此该方案是一种简单的方法,从而进一步增强了该方法的临床应用前景。
目前来说,人造血小板的成本还是高于捐献血小板。但这项研究表明,脂肪间充质干细胞可以通过一种相当简单的方法生产血小板。
iPS细胞生产血小板
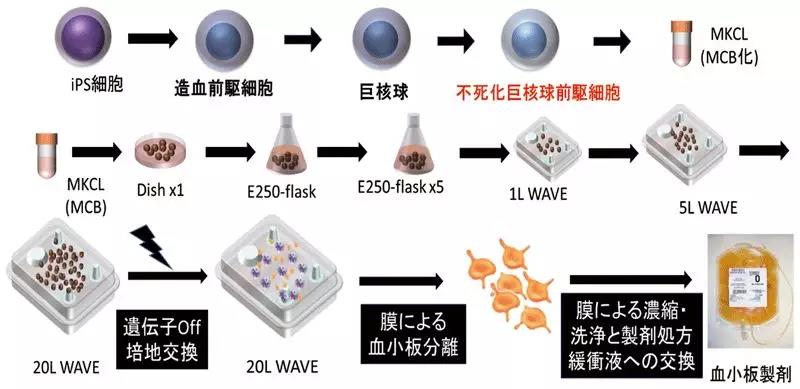
当然,利用iPS技术量产血小板早已在如火如荼进行中。日本株式会社megakaryon 就在专注这件事,其技术特点是通过iPS细胞中大量扩增并冻存由巨核细胞的前驱(前体)细胞,让其稳定供给和批量生产血小板成为可能。
在从iPS细胞中诱导出的造血前驱细胞中,导入多个基因,在分化诱导成巨核细胞后,依次扩大培育规模,让巨核细胞增殖。之后,再催熟增殖后的巨核细胞,使之释放出血小板。血小板经过分离、浓缩后,形成血小板制剂。
图 血小板批量制造方法概要
左至右、上至下=iPS细胞、造血前驱细胞、聚合细胞、无限繁殖的巨核细胞前驱细胞、基因Off 介质置换、通过膜分离出血小板、通过膜实现从浓缩洗净到制剂处方缓冲液的交换
还有更令人兴奋的事。今年,来自京都大学大学的Koji Eto团队,首次实现了临床应用级别的人工血小板生产,并将这一重要研究成果发表在顶级期刊《细胞》上。Eto教授自豪地说,“我们的这个发现是人造血小板走向临床应用的最后一个科学步骤。”
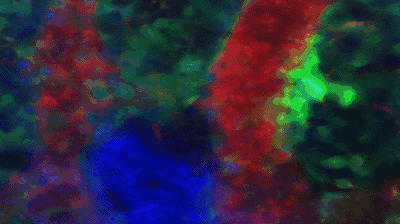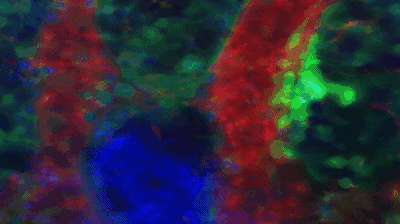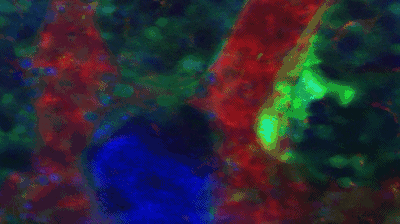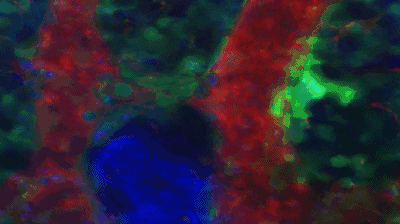
他们在研究中发现大量产生血小板的巨核细胞处于湍流之中,而处于静息状态,不产生血小板的巨核细胞周围则是层流。血小板竟然是被湍流乱棒“打”下来的!
在湍流中血小板从巨核细胞上脱落。图中绿色的是血小板和巨核细胞,红色是血流,蓝色是细胞核
于是,他们改进了一种叫做 VerMES的液体培养生物反应器,成功在8升的生物反应器中生产了1000亿个血小板,达到了临床使用的规模,并且解决了配型的问题。他们开发了一种通用血小板,这种血小板表面没有人类白细胞抗原,输入人体不会产生免疫排斥反应。
人造血小板会是2020年吗?
全球每年使用超过450万个单位血小板,这一数字目前需要全部由捐献者来满足。由于捐献的血小板保质期不足一周,供应常常无法满足患者的需要。此外,捐献的血小板还存在一定的安全风险,比如供体被感染、受体的免疫反应。
因此,人造血小板存在很大的市场前景。以日本为例,日本每年有 80 万人需要输注血小板,市场规模约在 700 亿日元(约43亿人民币)。日本人还打算把量产化的血小板卖去美国,美国血小板市场规模则在 2100 亿日元左右(128亿人民币)。
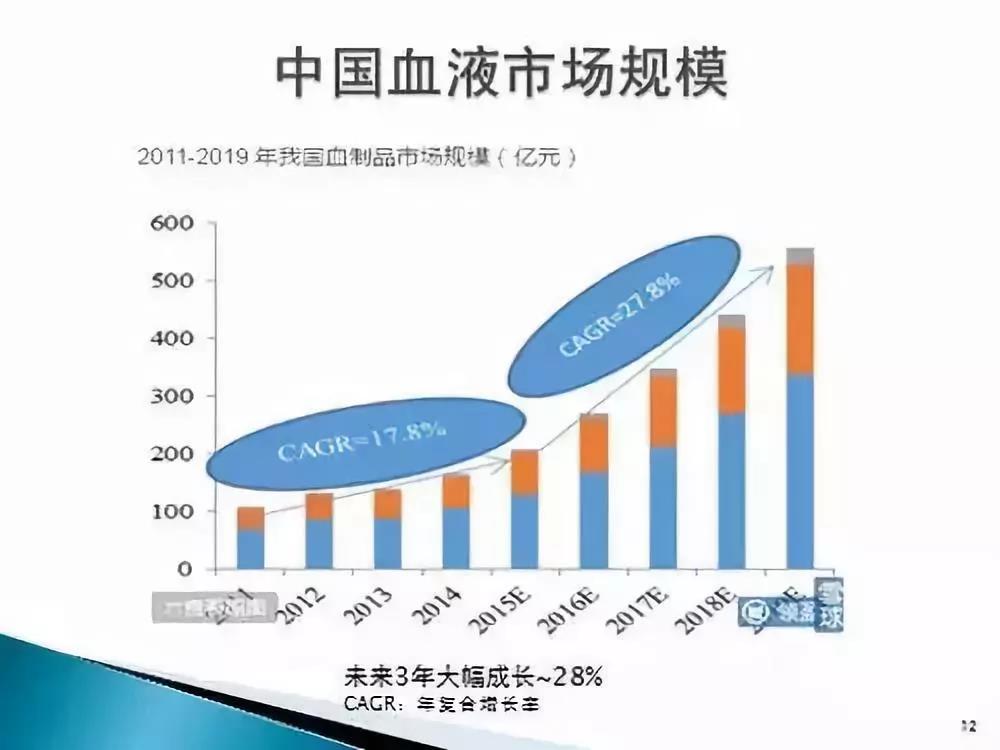
在中国,人造血小板也具有巨大的市场需求。全国血小板需求量预计为每年至少100万治疗单位。若每治疗单位(250毫升)血小板计价2000元,仅弥补市场需求即为20亿人民币的市场价值。
除了我们上述提到的研究。各国科学家及制药企业均瞄准了这一领域,有团队就在探索使用脐带血造血干细胞生成血小板的方法(如Genelon等)。
美国布莱根妇女医院曾开发一种可收缩的新一代血小板生物反应器,以便在体外制备功能完善的人血小板,相关研究结果发表在2014年7月21日的《Blood》杂志。
赛道的终点线,也就是日本业界所预测人造血小板的上市时间,很可能是在2020年左右。让我们期待有团队能够如期“撞线”,并能带来更好品质、更稳定的人造血小板产品,帮助人类彻底告别血小板荒。
血小板市场需求很大,用先进技术批量生产血小板是大势所趋。科学家利用多种技术制造血小板,让血小板产品质量更高,更好的帮助人类。
参考文献
[1]Platelets grown from stem cells may be alternative to donated platelets,American Society Of Hematology
Keiichi Tozawa, Yukako Ono-Uruga, Yumiko Matsubara, etc. Unique megakaryocytes and platelets from novel human adipose-derived mesenchymal stem cell line.Blood 2018 :blood-2018-04-842641
[2]《细胞》:有望彻底告别血小板荒!科学家首次实现血小板大规模体外生产,人造血小板走向临床应用的最后一步完成 |奇点猛科技
[3]人造血小板听起来晦涩,却能救人救命,还有一整片蓝海市场 |硅谷密探
[4]Ito Y, Nakamura S, Sugimoto N, et al. Turbulence Activates Platelet Biogenesis to Enable Clinical Scale Ex Vivo Production[J]. Cell, 2018.