CAR-T疗法在经过科研人员改良后,近年来得到了巨大的关注。临床上,这种新型细胞疗法在急性白血病和非霍奇淋巴瘤的治疗上有着显著的疗效。
近两年,免疫治疗可谓占尽风头,尤其在癌症治疗领域,免疫治疗取得了前所未有的突破,其中,随着Kymriah和Yescarta两种CAR-T免疫疗法的相继获批,CAR-T疗法更是成为了免疫治疗的最热门。
创造了“艾米丽”奇迹
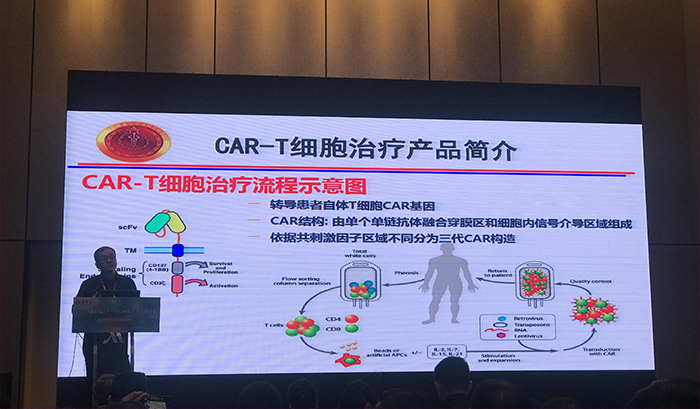
据了解,CAR-T疗法的全称是chimeric antigen receptor T cell therapy,即嵌合抗原受体T细胞疗法,原理是应用患者自身的T淋巴细胞,经过实验室重新改造,装载上具有识别肿瘤抗原的受体及共刺激分子,体外扩增后再次回输入患者体内,从而识别并攻击自身的肿瘤细胞。
研究界认为,肿瘤是人体内正常的体细胞发生基因突变而导致恶性增殖的产物,肿瘤之所以难以治疗,是因为它拥有一系列堪称完美的“免疫逃逸机制”来躲过人体免疫系统的监控和杀灭。对于人类的免疫系统来说,肿瘤和正常细胞“长得很像”,一般的免疫细胞很难在人体内众多细胞当中准确的辨认出肿瘤细胞,因此也不会对到处疯长的肿瘤细胞作出恰当的反应。
多年以来,对于癌症治疗,难点就在于如何开发出一种药物或疗法,既能够有效杀伤癌细胞,又能够尽量避开体内其他的正常细胞,而嵌合抗原受体(CAR)治疗技术,就是目前表现最优秀的一种技术之一。
回溯CAR-T疗法的发展,其于上世纪八十年代末被首次提出,而此前LAK、TIL、CIK等免疫细胞疗法的出现,则为
CAR-T疗法的后续研究奠定了基础,截至目前,CAR-T疗法已发展出四代:第一代CARs结构只包含抗原识别信号,在体内增殖能力有限;第二代和第三代CAR-T在信号转导区内,分别加入了一个和两个共刺激分子,以提高T细胞增殖活性、细胞毒性,延长T细胞存活时间;第四代CAR-T结构与前三代不同,引入了促炎症细胞因子和共刺激配体,主要目的是克服肿瘤免疫微环境的抑制。目前大多数公司产品还是采用的二代CAR-T,因为这是目前看来可能疗效稳定、副作用可控,治疗经验也最多的一代细胞免疫疗法。
2012年,一位被诊断出患有急性淋巴细胞白血病六岁小女孩艾米丽·怀特海德(Emily Whitehead)的在生命垂危之际,成为全球第一位接受试验性CAR-T疗法的儿童患者,如今,六年的时间过去了,艾米丽一直健康成长着,未出现肿瘤复发,直到现在,她的体内仍然能检测到存活的CAR-T细胞。
艾米丽的生存奇迹成为了后来诺华全球首个获批的CAR-T疗法Kymriah的强有力支持证据之一,也成为了CAR-T疗法各类研究的原始动力之一。
军事医学研究院毒物药物研究所研究员王全军于日前在上海国际医学园区举行的2018(第四届)下一代CAR&TCR-T研讨会上表示:“CAR-T疗法确实是在人体治疗上取得了不错的效果,除了艾米丽的经典个例,南京传奇此前披露的我国首个获批临床试验的CAR-T疗法LCAR-B38M也取得了喜人的数据,这极大增强了中国CAR-T疗法的研究,如果CAR-T疗法后面真的纯粹作为药物来进行管控发展,受众的人群会越来越多。”
同时,王全军还认为,现阶段的CAR-T疗法多数还处于个体治疗阶段,但是未来肯定会发展通用型的,即无需从患者体内采集免疫细胞,所用的免疫细胞均由健康人提供。
生产工艺的特殊性
质量永远是新药研发的核心,生物技术药物特别是细胞类产品药物的质量管控尤为重要,而生产工艺则是其中最重要的一环。
王全军指出,CAR-T作为一类“活”的药物,其整个生产工艺很复杂,与中药、化学药等有很大的区别,包括自体细胞筛查、质粒生产、病毒包装等有着非常严格的要求。“CAR-T的生产环境一定要符合GMP的车间要求,目前,据我了解,国内大部分做细胞产品要完全符合GMP车间的要求还是比较有难度,但最终肯定要按照GMP车间要求来进行。”王全军说道。
今年6月,中国食品药品检定研究院发布了《CAR- T 细胞治疗产品质量控制检测研究及非临床研究考虑要点》(以下简称《要点》),该《要点》 CAR- T细胞产品的生产工艺及产品特性为主线,对CAR- T细胞治疗产品的适用范围、原材料和辅料的选择及质量控制等多方面进行了详细规定。
对于该《要点》,王全军表示:“2017年12月,原国家食品药品监管总局发布《细胞治疗产品研究与评价技术指导原则(试行)》,为按照药品研发的细胞治疗类产品提供了规范性文件和申报的路径;2018年3月,国家药审中心发布《细胞治疗产品申请临床试验药学研究和申报考虑要点》和《当前对CAR- T类产品非临床研究与评价的一些考虑》, CAR- T的药学和非临床研究给出了初步的框架性指导意见,此次中检院发布的《要点》是在以上文件基础上进行了更深一步的细化与明确,对于创新性非常高的药品,《要点》从技术角度考虑了产品的安全性和有效性,从工艺阶段突出产品的一致性要求,最大限度降低产品的可变性,这有利于CAR- T细胞产品的规范和质量统一,促进CAR- T产品安全性、有效性、质量可控性和工艺一致性的快速发展。
但王全军也指出,一份《要点》很难包括所有问题,并解决所有风险,在使用过程中还需要采用“个案分析”的方式,处理不同品种研发过程中出现的不同问题,并针对出现的新问题逐步完善解决。
为此,王全军建议,CAR- T细胞产品在生产流通过程中还应关注“产品装瓶和运输过程中的风险”,建立“质量风险管理(QRM)体系,构建对应的前期风险危害性分析工具,制定风险开展策略与标准”。
以不同的动物模型评估有效性和安全性
会上,王全军还着重提到了CAR- T类产品的毒副作用,和许多药物和治疗方式一样,CAR-T疗法也存在副作用,如引起发烧、肌痛等细胞因子风暴反应,甚至有患者在临床试验中因此死亡。比如2017年9月,法国制药公司Cellectis就宣布,一名78岁急性浆细胞样树突状细胞瘤男性患者,在临床试验中经CAR-T治疗约10天后死亡,该患者曾经历5级细胞因子释放综合征和4级毛细血管渗漏综合征。
同时,据王全军介绍,除了毒副作用,CAR- T疗法还面临着脱靶效应、过敏反应和神经毒性、病毒载体的缺陷等问题的挑战。
中国医学科学院血液学研究所主任医师王建祥在该会上就提到:在临床试验中,病人明明几小时前还好好的,坐着床上还嗑着瓜子,几小时后,病人突然就去世了,因为发生了严重的突发性神经毒性事件。
由此,在人体使用前获得CAR-T产品的有效性和安全性等非临床信息至关重要,王全军表示,选择合适的动物模型进行上述相关研究可以大大提高对临床结果的预测性。目前,已用于CAR-T产品研究和正处于探索阶段的动物模型主要包括同源小鼠模型、转基因小鼠、移植瘤小鼠模型、免疫系统重建人源化小鼠以及灵长类动物模型。
但是,王全军也指出,由于CAR-T细胞产品的个性化程度高,人和动物免疫系统特性存在差异,人源细胞在动物体内易受到免疫排斥等原因,目前尚未有任何一种动物模型能完全模拟人类的免疫系统以及肿瘤微环境。因此,需要根据产品特点和研究目的,构建或者选择适当的动物模型,为CAR-T细胞治疗产品非临床研究提供有效的研究工具。
王全军举了个例子,比如,免疫系统重建人源化小鼠模型主要用于研究人类免疫系统环境下肿瘤的生长情况,评估CAR-T细胞抗肿瘤治疗效果及相关毒性作用机制,它们对人源CAR-T细胞具有较好的耐受性。人源化小鼠模型的构建通常是在免疫缺陷鼠如NSG小鼠等进行CAR-T细胞治疗前移植人的CD34+造血干细胞/祖细胞(Human CD34+ Hematopoietic Stem / Progenitor Cells, CD34+ HSPCs),HSPCs可以再生少量髓系和部分淋巴系细胞,向免疫缺陷鼠移植人的骨髓、肝脏和胸腺的人源化BLT小鼠模型,其构建更加复杂,是目前最接近人免疫系统的动物模型。
免疫人源化小鼠模型由于同时具有人的免疫系统并可以移植人源肿瘤组织,从而能够真实模拟人免疫系统与肿瘤相互作用的过程,在临床前CAR-T细胞产品抗肿瘤评价体系中具有其独特优势。在临床前药效学评价方面,有研究已经证明该小鼠模型能够反映出肿瘤的异质性,在做临床预测时,更接近真实的临床结果。
“虽然目前我们对于CAR-T等细胞免疫治疗产品的研究还存在一定的局限性,比如动物评价模型的不足,难以弥补全细胞生命周期的安全性评价,检测手段的缺乏,难以完全阻止临床的不良反应,但是,对于其未来的临床应用,我们会让它变得逐渐‘完美’起来。”王全军最后如是说道。
临床上,CAR-T疗法还有很多不足,但是相信在不久的将来科研人员会将这个疗法完善,做到真正意义上安全有效。