根据美国FDA书面答复:如果其临床2期试验能够达到主要终点,可以以此作为BLA申请的依据。这意味着
VY-AADC基因疗法有望提前获得审批,加速上市进程,这对患者而言的确是令人激动的喜讯。
帕金森病(
PD),又名震颤麻痹,是仅次于阿尔茨海默病(Alzheimer's Disease, AD)的第二大常见神经退行性疾病,全球约 700 万至 1000 万人患有该病。初期表现为震颤、运动缓慢、僵硬、姿势不稳定等,到晚期发展到无法迈步、语言和吞咽困难等,导致生活无法自理。早期帕金森病患者可以通过左旋多巴较好地控制病情,但随着疾病进展,患者对治疗的响应会变得越来越差。
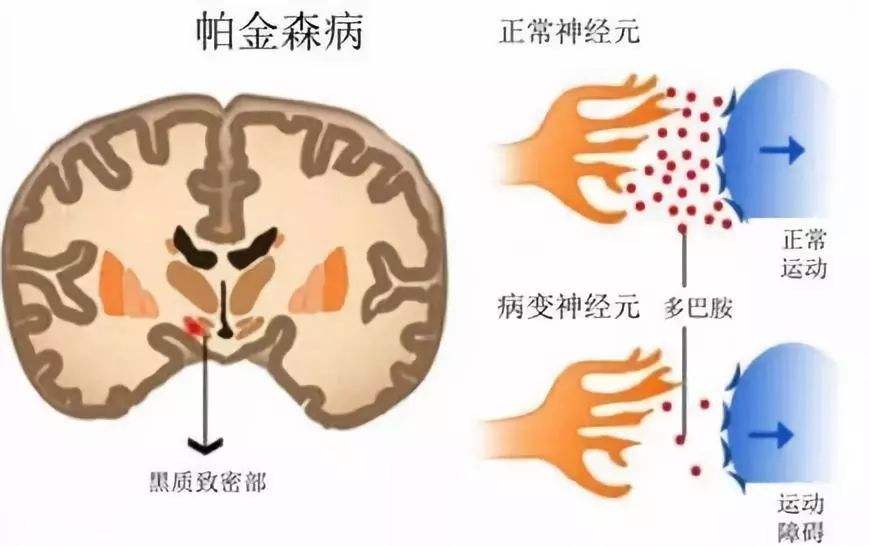
虽然PD的发病机制尚未明确,不过大量研究证实PD典型的病理特点是中脑黑质多巴胺能神经元缺失,口服补充左旋多巴是标准治疗方法。但左旋多巴只能减轻症状不能延缓病情加重,且随着疾病进展,患者对治疗的反应变差,经历较长时间的运动缓慢和僵硬,用药也无法达到最佳效果,这一时期叫做“关闭期(OFF-time)”。药物起效的时间,也就是“开启期(ON-time)”也变短。
目前能够有效延缓或阻止帕金森病发生的治疗方法和药物仍然很少,VY-AADC基因疗法作为该疾病治疗方面的一款充满潜力的疗法,受到医学界广泛的关注。
晚期帕金森病患者的中脑黑质里的神经元会出现退化,壳核中的AADC酶也显著减少,限制了大脑将左旋多巴转化为多巴胺的能力。而VY-AADC基因疗法是将AADC基因直接递送至多巴胺受体所在的壳核神经元中,绕过黑质神经元,使壳核中的神经元表达 AADC 酶,将左旋多巴转化为多巴胺。因此,VY-AADC基因疗法有望持久地增强多巴胺的转化,通过一次施药恢复患者的运动功能并缓解症状,从而提供具有临床意义的改善。
VY-AADC基因疗法在1b期临床试验中,彰显出持续改善患者运动功能的能力,也大幅减少了每日口服左旋多巴和其他帕金森病药物的使用。为此,曾在2018年6月获得了美国FDA颁发的再生医学先进疗法RMAT)认定。
最近,VY-AADC基因疗法的2期和3期关键临床试验计划得到了美国FDA的认可。如果其临床2期试验能够达到主要终点,可以以此作为BLA申请的依据。
RMAT认定和FDA的书面反馈让研发团队很受鼓舞,“我们的
VY-AADC项目进展良好,且得到了C类监管的进一步反馈意见,” Andre Turenne先生说道:“我们感谢监管部门的指导,也期待能让反馈整合进我们正在推进的关键项目中。”