近日,
再生医学网小编读到一篇好文章,特和大家进行分享。
生物医用材料是现代医学的两大支柱--生物技术和生物医学工程的重要基础,随着生物材料科学的不断发展,新型生物医用材料的组成、形态、植入部位及用途日趋复杂,而相容性评价始终是生物医用材料研究中贯穿的主题。
1 生物医用材料类型
目前生物医用材料种类繁多,主要分为三大类:(1)天然高分子生物材料,如胶原蛋白、明胶、纤维蛋白、壳聚糖、琼脂、糖胺多糖、藻酸盐、丝素蛋白、几丁质、松质骨骨基质、脱细胞基质等。(2)合成高分子生物材料,如硅橡胶、聚乙烯、聚氨酯、聚丙烯酸酯聚乳酸、聚羟基乙酸等。(3)复合高分子生物材料,如明胶/硫酸软骨素/透明质酸钠、聚氧化乙烯/甲壳素/壳聚糖、壳聚糖/明胶、丝素蛋白/羟基磷灰石、聚乳酸/纳米羟基磷灰石/氧化石墨烯纳米等复合生物材料。
2 生物医用材料生物相容性的检测
2.1 细胞毒性的检测
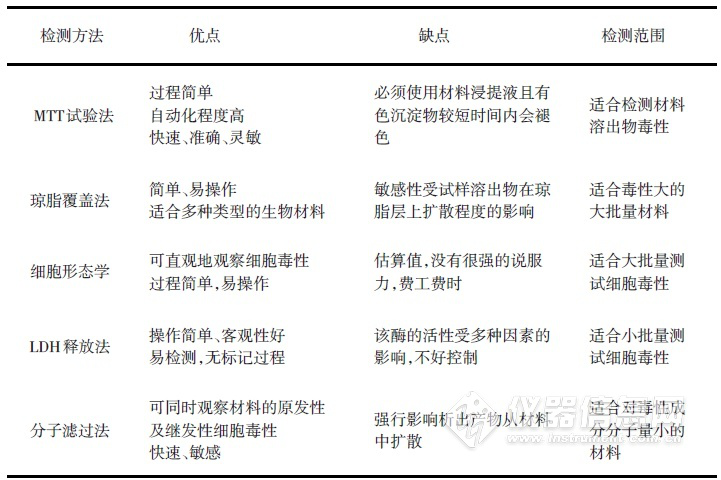
采用体外细胞毒性试验对生物材料和医疗器材或浸提液可滤出成分中潜在的细胞毒性评价是常用方法,一般以体外细胞培养方法进行。细胞毒性实验研究周期短,已被广泛用于生物材料生物相容性评价中,特点是简便、敏感,节省经费、节约动物。
有多种方法检测细胞毒性,GB/T16886 标准分为MTT试验法(主要是浸提液法)、直接接触法、分子滤过法和琼脂覆盖法。还有按照不同的生物学评价指标对细胞毒性检测进行评价,如细胞形态学、细胞膜效应(LDH释放法)、细胞代谢活性、细胞增殖率等方法。另有细胞周期、细胞凋亡和细胞增殖相关蛋白检测等方法评价细胞毒性。
2.2 血液相容性评价
评价生物材料与血液接触时对机体血液破坏的量度,即血液相容性评价。具体指形成血栓、红细胞破坏、减少或激活血小板;凝血因子和补体系统是否激活;血液中各种酶活性是否改变;有害免疫反应是否发生等,血液生理生化反应是相互联系又同时发生。心血管体系的生物材料更需要具有非常优良的血液相容性。由于内环境理化因子的复杂性与多变及凝血机制,因此生物材料需要经体内和体外实验进行血液相容性评价,具体评价方法和指标还未标准化。血液相容性评价一般采用体外实验、半体内试验和体内试验。
2.3 遗传毒性和致癌试验
体外检测遗传毒性和致癌实验常用Ames实验,由细菌介导的检测基因毒物的一种方法,也是检测基因突变最常用的方法。由于Ames实验菌种的变异,致使假阴性率的实验结果由10%增加到30%~40%,因此,需要进行体外染色体畸变试验和微核试验相互补充,对遗传毒性进行科学评价。分子检测在遗传毒性和致癌试验的评价中有特殊意义, 可取代某些大型动物试验(如啮齿类动物)。核酸检测技术,可在基因转录水平和翻译水平上研究生物材料对细胞的影响。
2.4 植入实验
植入实验是材料的生物相容性和安全性评价的主要检测方法,有两种方法:皮下植入和骨内植入。对与机体组织长期接触的材料可选皮下植入实验以检测材料与皮下组织器官的反应。选择同种、同龄、同性别实验动物,将受试材料与对照材料分别植入同一部位,试验周期4至12周不等。定期取材评价动物的生物反应,进行大体观察和组织病理学评价。长期皮下植入外来生物材料条件下能否引发机体组织产生肿瘤是新一代人工器官及生物材料研发急需解决的问题。骨内植入实验常选实验动物的左右肢股骨外侧或者胫骨内侧作为植入位置,在同一部位的一侧放置受试样品另一侧放置对照样品;另外可选牙槽骨植入。观察动物的反应并记录异常表现,至实验结束时对植入体周围组织进行生物评价。
2.5 过敏反应实验
过敏实验中必须设立阴性对照组,遵循随机化原则分组。以腹腔注射途径给予实验动物浸提液处理,观察动物的生理反应,特别观察末次注射后的变化,如用爪搔鼻、喷嚏、竖毛、抽搐、呼吸困难、尿便失禁、休克、死亡等反应。
3 结束语
随着生物医用材料科学的不断发展,新型生物医用材料的组成、形态、植入部位及用途日趋复杂,而生物医用材料的生物相容性评价却发展较慢。
(备注:图片源自网络。)