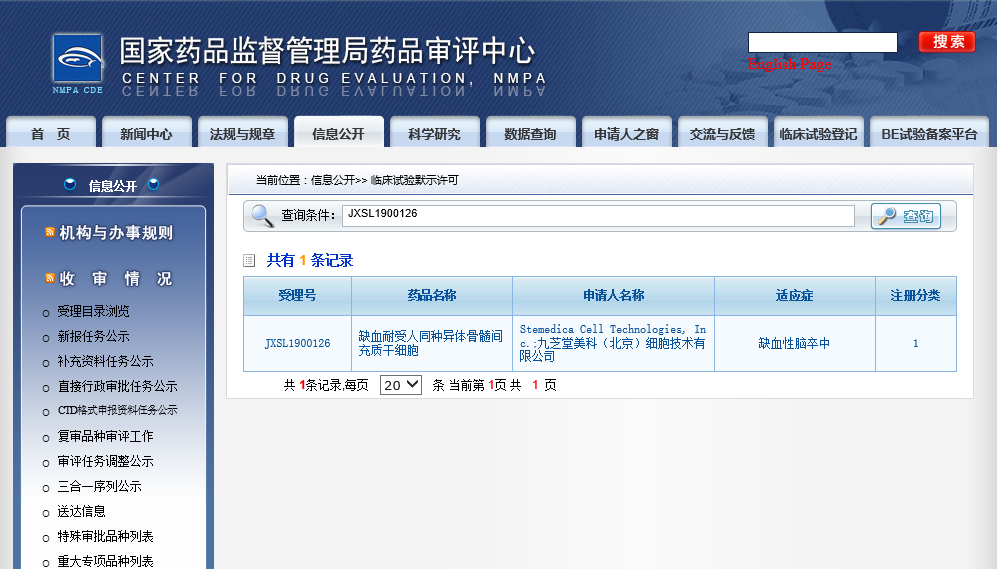
再生医学网了解到,2月19日,九芝堂收到国家药品监督管理局药物审评中心(CDE)签发的《临床试验通知书》:“根据《中华人民共和国药品管理法》及有关规定,经审查,2019年11月15日受理的缺血耐受人同种异体骨髓间充质干细胞符合药品注册的有关要求,同意按照提交的方案开展缺血性脑卒中的临床试验。”这标志着该公司干细胞临床试验申请获得批准,九芝堂美科将与首都医科大学附属北京天坛医院合作开展治疗缺血性脑卒中的临床试验。
据悉,CDE共受理了12家企业申报的13项干细胞研究型新药(IND)申请,共批准6项。在美科IND之前,获批的前5项IND使用干细胞均为国产,细胞来源包括脐带、自体脂肪等,涉及的适应症有膝骨关节炎、糖尿病足溃疡、移植物抗宿主病等。此次美科IND获批,是CDE批准的第一项使用进口干细胞进行的临床试验,第一项使用骨髓来源间充质干细胞进行的临床试验,也是第一项使用干细胞治疗神经系统大适应症的临床试验,对我国干细胞产业的发展具有标志性意义。
据了解,本次临床试验所用干细胞产品为美国Stemedica Cell Technologies, Inc.(以下简称Stemedica)生产的缺血耐受人同种异体骨髓间充质干细胞(ithMSC)。Stemedica公司成立于2005年, 2010年获得了美国加利福尼亚州政府颁发的生产许可证,至今已经在GMP条件下运行了近10年时间,是世界上少数能够在cGMP条件下生产骨髓间充质干细胞和神经干细胞产品的企业。Stemedica公司在全程低氧条件下生产的缺血耐受人骨髓间充质干细胞(ithMSC)产品,其生产工艺和质量体系符合美国FDA 和cGMP 要求。在美国已经获得6项IND,被Life Technology公司(已被赛默飞收购)评为“同类最佳”产品。自2012年以来,Stemedica发表高水平研究论文15篇,获得专利7项。Stemedica已在全球多个国家开展多个适应症的临床试验,其中ithMSC治疗急性心肌梗死已在哈萨克斯坦完成III期临床试验,获哈萨克斯坦卫生部批准上市。
(备注:图片源自网络。)




