迈威生物(688062.SH),一家全产业链布局的创新型生物制药公司,宣布其自主研发的9MW3811注射液于近日正式获得澳大利亚治疗用品管理局(TGA)批准开展临床试验。9MW3811注射液适应症为多种晚期恶性肿瘤以及纤维化疾病。目前,9MW3811是全球同靶点药物中首个开展临床试验的单抗品种。
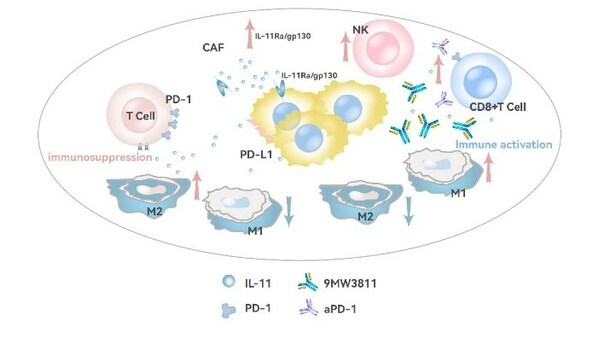
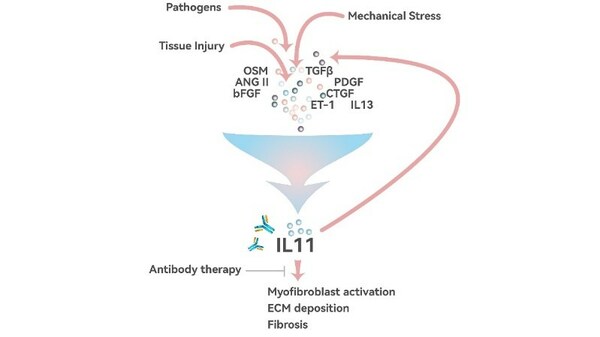
9MW3811是创新靶点人源化单克隆抗体,可高效阻断IL-11下游信号通路的激活,从而达到对纤维化和肿瘤的治疗效果。
9MW3811的抗肿瘤作用机制
9MW3811的抗纤维化作用机制
9MW3811是第一款进入临床阶段的靶向IL-11的单克隆抗体,也是IL-11靶点第一款进入临床阶段的非重组蛋白药物。
关于迈威生物
迈威生物(688062.SH)是一家全产业链布局的创新型生物制药公司,始终秉承"让创新从梦想变成现实"的愿景,践行"探索生命,惠及健康"的使命,通过源头创新,为患者提供疗效更好、可及性更强的生物创新药,满足全球未被满足的临床需求。2017年成立以来,迈威生物构建了以抗体药物靶点发现与分子发现为起点,覆盖成药性研究、临床前研究、临床研究和生产转化等药品研发全周期的创新体系,实现集研发、生产、营销于一体的全产业链布局。我们专注于肿瘤和年龄相关疾病,涉及自身免疫、肿瘤、代谢、眼科、感染等治疗领域,凭借国际领先的五项特色技术平台和研发创新能力,建立了丰富且具有竞争力的管线。现有16个品种处于不同阶段,包括12个创新品种和4个生物类似药,其中1个品种上市,2个品种上市申请获得受理,3个品种处于关键注册临床试验阶段。并独立承担1项国家"重大新药创制"重大科技专项、2项国家重点研发计划和多个省市级科技创新项目。迈威生物以创新为本,注重产业转化,符合中国NMPA、美国FDA、欧盟EMA GMP标准的抗体和重组蛋白药物产业化基地已在江苏泰州投入使用,并已通过欧盟QP审计,位于上海金山和江苏泰州的大规模商业化生产基地正在建设中。欲了解更多信息,请访问:www.mabwell.com。
前瞻性声明
本新闻稿所发布的信息中可能会包含某些前瞻性表述。这些表述本质上具有相当风险和不确定性。在使用"预期"、"相信"、"预测"、"期望"、"打算"及其他类似词语进行表述时,凡与本公司有关的,目的均是要指明其属前瞻性表述。本公司并无义务不断地更新这些预测性陈述。
这些前瞻性表述乃基于本公司管理层在做出表述时对未来事务的现有看法、假设、期望、估计、预测和理解。这些表述并非对未来发展的保证,会受到风险、不确性及其他因素的影响,有些乃超出本公司的控制范围,难以预计。因此,受我们的业务、竞争环境、政治、经济、法律和社会情况的未来变化及发展的影响,实际结果可能会与前瞻性表述所含资料有较大差别。
本公司、本公司董事及雇员代理概不承担(a)更正或更新本网站所载前瞻性表述的任何义务;及(b)若因任何前瞻性表述不能实现或变成不正确而引致的任何责任。