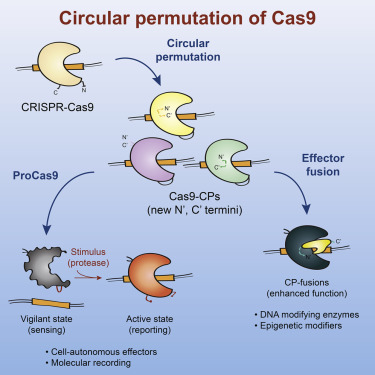
<研究示图>
近日,来自美国加州伯克利分校的科学家们开发出一项新研究,该研究利用循环排列技术,构建一套新型Cas9变体,这将简化Cas9融合蛋白的设计,使得它们能够用于除了简单的DNA切割之外的多种应用,比如碱基编辑和表观遗传修饰,研究人员将这套新型基因编辑工具称为Cas9-CP。目前,该研究已经发表于国际知名医学期刊《CELL》上。
通过这个相同的过程,这些研究人员将“永远开启(always-on)”的Cas9分子转变为可激活的开关。这些开关保持在“关闭”位置,直到它们被蛋白酶激活。由此产生的蛋白酶感应的Cas9(protease-sensing Cas9, ProCas9)能够减少脱靶效应并实现分子感应,以及组织或器官特异性的基因组编辑。他们证实ProCas9可用于检测病毒蛋白酶,从而潜在地用作一种能够引发免疫反应的病原体感应系统。
论文通讯作者、加州大学伯克利分校生物化学家David Savage说,“我们并没有坚持使用大自然给我们提供的基因组编辑蛋白。这些蛋白能够经精心优化后变成适合在人细胞中使用的支架。”
诸如Cas9之类的CRISPR-Cas蛋白保护细菌免受病毒入侵。这种细菌防御系统已被改用于基因组编辑应用,比如让各种细胞类型和有机体中的基因失活。Cas9已进化为一种细菌防御系统,但是它不一定具有在哺乳动物细胞中进行基因组编辑所需的特性,比如基因组靶向时的极高准确度和精确度,或对这种酶在空间和时间上的活性进行控制的能力。
尽管构建出的Cas9融合蛋白有效地编辑DNA中的碱基,或者通过表观遗传修饰激活或抑制转录,但是每个新应用都需要深入的工程学方法并进行费时费力的优化。另一个主要障碍在于Cas9始终处于“开启”状态。缺乏对这种蛋白的活性的控制使得难以靶向特定细胞或组织,从而能够导致不想要的基因组编辑和更大的脱靶基因组损伤,并且阻止使用Cas9作为细胞事件的分子记录器。
为了克服这些障碍,Savage和他的团队使用循环排列来重新设计Cas9的分子序列,因而更好地控制它的活性并为融合蛋白构建更优化的DNA结合支架。这种Cas9重新连接方法涉及将这种蛋白的末端(即它的氨基端和羧基端)与肽接头(peptide linker)连接,同时在不同的位置上分割它的序列,从而产生新的相邻的氨基端和羧基端。
这些研究人员发现Cas9对循环排列具有很强的延展性。这种蛋白的多个区域具有热点,这些热点可在多个位置上打开,从而产生多样性的Cas9-CP,所产生的Cas9-CP可用作高级融合蛋白的支架。目前,Cas9的氨基端和羧基端是固定的,并且它们并不适合放置用于结合DNA的融合蛋白。相比之下,这些新的蛋白支架的末端更靠近这种蛋白的DNA相互作用界面,并且经优化后可高效地构建融合蛋白。
这些研究人员接下来通过设计肽接头来产生ProCas9,并且这种肽接头足够短以便将这种蛋白限制在没有活性的状态,随后引入可利用匹配的病毒蛋白酶加以切割的序列。此后,这些ProCas9经调整后可作为利他的能够检测病原体并对它们作出反应的防御系统。当通过切割这种肽接头激活这些ProCas9时,它们产生大量的DNA损伤并杀死受感染的细胞。
论文共同第一作者、加州大学伯克利分校的Christof Fellmann说,“我能够畅想一下各种生物医学应用,在这些应用中,Cas9-CP和ProCas9将允许我们更好地了解疾病过程,并且能够让CRISPR-Cas基因组编辑和修饰的转化应用更加安全。”
在未来的研究中,这些研究人员将致力于开发Cas9融合蛋白,用于碱基编辑和表观遗传修饰。此外,他们计划测试ProCas9是否可用于构建完整的合成免疫系统。人们也可能开发对内源性蛋白酶敏感的ProCas9用于靶向特定细胞,比如对癌细胞的基因组进行编辑。Savage说,“我们的ProCas9系统在任何适合于控制Cas9的情况下都是有用的。”
以CRISPR-Cas9基础的基因编辑技术在一系列基因治疗的应用领域都展现出极大的应用前景,例如血液病、肿瘤和其他遗传疾病。目前,该技术成果已应用于人类细胞、斑马鱼、小鼠以及细菌的基因组精确修饰。