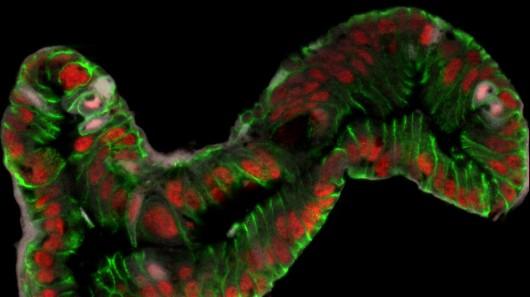
小肠上皮具有快速更新的能力,是研究成体干细胞的理想系统,小肠上皮由绒毛和隐窝两部分组成,而位于小肠隐窝底部的小肠干细胞是其持续更新的源泉。近年来,以Lgr5为代表的小肠干细胞标记物的发现、Lgr5+小肠干细胞的分离培养和多种转基因小鼠模型的出现,极大地促进了对小肠干细胞自我更新和分化调控的研究,使得人们可以更加深入地认识小肠干细胞命运决定的分子机制。
近日,复旦大学生命科学学院、遗传工程国家重点实验室赵冰、林鑫华团队揭示了染色质重塑(Chromatin Remodeling)决定小肠干细胞(Intestinal Stem Cell)命运的分子机制,研究成果于3月6日在线发表于《自然通讯》(Nature Communications)。该研究整合小鼠遗传学、类器官培养和分子细胞生物学方法,首次揭示染色质重塑在哺乳动物成体干细胞命运决定与组织稳态维持中的核心作用,并阐释了染色质重塑因子Znhit1调控基因时序表达的分子机制。此项工作对全面理解成体干细胞命运决定方式具有重要意义,并为干预肠炎、结肠癌等肠上皮相关疾病提供了理论基础。
表观遗传事件在生物体性状塑造中发挥关键作用。除经典的DNA甲基化和组蛋白修饰外,核小体组分变化(如:组蛋白变异体插入)引发的染色质重塑,也是表观遗传调控基因时序表达的重要形式。染色质重塑复合物SRCAP可主动介导组蛋白变异体H2A.Z对核小体中H2A的替换,但染色质重塑如何调控哺乳动物成体干细胞命运决定方式与组织稳态还有待研究。
赵冰、林鑫华团队长期以小鼠和果蝇为模式动物,探究成体干细胞命运决定机制。本项工作源于在果蝇中肠干细胞中进行的全基因组遗传筛选,研究者构建了染色质重塑复合物SRCAP关键亚基Znhit1的条件敲除小鼠,并证实Znhit1对小肠干细胞出生后建立和维持是必须的。机制上,Znhit1通过介导H2A.Z在命运决定关键基因(Lgr5, Tgfb1, Tgfbr2等)转录起始位点的插入,发挥转录调控作用,支持小肠干细胞干性。研究人员通过进一步机制探索发现,Znhit1对SRCAP复合体正常运转至关重要,其能够维持H2A.Z与其伴侣亚基YL1的结合。该研究得到国家自然科学基金和上海市启明星计划的资助。
小肠上皮肩负着消化食物、吸收营养和抵御病菌入侵的重任,与食物、细菌的持续作用致使每天有大量的上皮细胞凋亡、脱落。为了维持小肠的正常生理功能,小肠干细胞需要快速地自我更新和分化,以弥补上皮细胞的损伤。因此,研究小肠干细胞自我更新的调控机制显得尤其重要和必要。